
技術文章
液相色譜 - 質譜(LC-MS)已成為許多具有挑戰性的分析的首xuan分析技術,基于其選擇性,靈敏度和對不同極性化合物的廣泛適用性。盡管該技術具有優勢,但LC-MS系統的復雜性常常使分析人員難以滿足方法檢測限制。在“Column Watch”的這一部分中,討論了幾種策略,通過減少污染物,仔細選擇LC方法條件以及優化MS接口設置來提高方法靈敏度。通過了解這些參數與電離效率之間的關系,分析人員可以提高其信噪比并實現LC-MS技術的隱藏潛力。
在質譜(MS)中,術語靈敏度可具有通常可互換使用的若干含義。靈敏度可定義為每單位分析物濃度變化的信號變化(例如校準曲線的斜率)[1]。更常見的是,它用于參考MS檢測器中分析物產生的信號的大小。在后一種用法中,MS靈敏度通常用于比較檢測器。
從根本上說,檢測器提供定量數據的能力是分析物的信噪比(S / N)的函數。檢測限(LOD)由分析物S / N確定,是物質的低濃度,其信號可與系統噪聲區分開來[2]。如圖1所示,如果背景噪聲保持不變,則MS的靈敏度越高,給定方法LOD的S / N值越大。因此,通過操縱S / N可以發生靈敏度的提高。MS優化,樣品預處理策略,流動相組成和LC色譜柱特性都是電離效率*的,并且在優化時會改善分析物信號。同樣,限制有助于信號抑制或加合物形成的污染物也可以增強響應。
圖1 假設線性校準和固定背景噪聲,假設增加靈敏度對檢測限(LOD)的影響。 |
MS優化
在液相色譜 - 質譜(LC-MS)中,靈敏度直接關系到從溶液中的分析物產生氣相離子的效率(電離效率)以及將它們從大氣壓轉移到MS系統的低壓區的能力。 (傳輸效率)[3]。電離和傳輸效率的優化取決于LC方法參數和目標分析物或分析物。為了進行適當的調整,有必要對MS源中發生的機制有基本的了解。
電噴霧電離(ESI)是zui流行的電離技術之一; 因此,它將成為本專欄文章的重點。然而,重要的是要注意,無論選擇何種電離模式,都必須優化源參數。當LC流動相流入樣品毛細管時,基于所選擇的極性分離正離子和負離子。在正ESI中,負離子在毛細管壁上被中和,并且正離子在流動相中繼續到毛細管,其中帶電分析物累積成液滴。在施加電壓的影響下,形成泰勒錐[4]。靜電排斥導致錐體破碎成小的帶電液滴,然后,在毛細管和采樣板之間施加的電位差的引導下,它朝向采樣孔行進。隨著微小液滴向孔口前進,溶劑在干燥氣體和熱量的作用下蒸發,導致液滴表面積減小,電荷密度增加。終,排斥力克服液滴表面張力,液滴爆炸成更小的液滴。該過程重復進行,直到液滴太小以至于發射出氣相離子[5]。形成的離子云被稱為 終,排斥力克服液滴表面張力,液滴爆炸成更小的液滴。該過程重復進行,直到液滴太小以至于發射出氣相離子[5]。形成的離子云被稱為 終,排斥力克服液滴表面張力,液滴爆炸成更小的液滴。該過程重復進行,直到液滴太小以至于發射出氣相離子[5]。形成的離子云被稱為離子羽。
選擇合適的極性是開發靈敏的LC-MS方法的步。選擇毛細管極性以匹配目標分析物的電荷。通常,堿性分析物通過接受質子(M + H)+以正離子模式zui有效地電離,而酸性分析物通過提供質子(MH)-將在負離子模式中產生zui強的信號。然而,對于更復雜的分子,可能難以預測*極性模式。此外,分析物的行為和響應因儀器平臺而異。因此,在初始方法開發期間或將現有方法轉移到新儀器時,使用兩種極性模式篩選分析物是有益的[6]。
電離效率受流速,流動相組成和目標分析物的物理化學性質的強烈影響。毛細管電壓設置取決于分析物,洗脫液和流速,并且可能對方法重現性產生重大影響。毛細管和采樣板之間施加的電位差是維持穩定和可重復噴霧的原因[7]。如果毛細管電壓設置不正確,可能會出現可變電離和精度問題。*霧化氣體流量和溫度也取決于洗脫液。霧化氣體限制了液滴的生長,同時電荷累積并且還影響從毛細管發射的液滴的尺寸。應增加霧化氣體流量和溫度以獲得更快的LC流速或使用高含水流動相時。類似地,干燥氣體流量和溫度對于LC洗脫液的有效去溶劑化和氣相離子的成功生產是關鍵的。需要注意的是,在分析熱不穩定分析物時,必須注意防止其在源中降解。
在電離源內產生氣相離子的位置對于*傳輸到MS系統是重要的。離子羽流的大小取決于發射氣相離子所需的裂變事件的數量及其與采樣孔的距離。通過基于LC流速調節毛細管相對于孔口的位置,可以優化離子羽流的取樣。在更快的流速下,毛細管應放置在離采樣孔更遠的位置,以便進行充分的去溶劑化和增加裂變事件的數量。盡管延長距離將允許產生更多數量的氣相離子,但排斥力也將成比例地增加,導致離子羽流的尺寸擴大并且氣相離子的密度減小。結果是,進入采樣孔的離子數量會減少,導致信號強度下降[3]。在較慢的流速下,形成較小的液滴,使毛細管更靠近取樣孔。較小的液滴更容易去溶劑化并且需要更少的裂變事件,減少排斥力的影響并抑制離子羽流的大小。毛細管和采樣孔之間的距離減小會增加離子羽流密度,提高分析物的電離效率和傳輸效率[3]。減少排斥力的影響并抑制離子羽流的大小。毛細管和采樣孔之間的距離減小會增加離子羽流密度,提高分析物的電離效率和傳輸效率[3]。減少排斥力的影響并抑制離子羽流的大小。毛細管和采樣孔之間的距離減小會增加離子羽流密度,提高分析物的電離效率和傳輸效率[3]。
如Szerkus及其同事分析尿液中7-甲基鳥嘌呤和葡萄糖醛酸所證明的,上述電離源參數的優化可能會帶來2到3倍的靈敏度增益[8]。在優化源條件時,使用預期的LC流動相和流速非常重要。一種優化方法是多次注入標準溶液,并在每次注射時逐步改變特定的源參數。圖2展示了評估兩種農藥*去溶劑化溫度的過程:甲an磷和甲氨基阿維菌素B1a苯甲酸鹽。通過將去溶劑化溫度從400℃提高到550℃,使甲an磷的響應增加20%。相反,如果去溶劑化溫度超過500°C,由于該化合物的熱不穩定性,甲氨基阿維菌素苯甲酸鹽B1a經歷*信號損失。或者,可以通過將恒定流量的分析物引入LC洗脫液并監測分析物TIC來優化源條件。該技術允許在運行中進行調整。使用多種化合物的梯度洗脫方法應通過估算洗脫時的有機物濃度來優化。盡管這一步驟勢不可擋,但只需將工作集中在關鍵或低強度分析物上即可簡化該過程。該技術允許在運行中進行調整。使用多種化合物的梯度洗脫方法應通過估算洗脫時的有機物濃度來優化。盡管這一步驟勢不可擋,但只需將工作集中在關鍵或低強度分析物上即可簡化該過程。該技術允許在運行中進行調整。使用多種化合物的梯度洗脫方法應通過估算洗脫時的有機物濃度來優化。盡管這一步驟勢不可擋,但只需將工作集中在關鍵或低強度分析物上即可簡化該過程。
圖2 在四次連續注射中,(a)甲an磷和(b)甲氨基阿維菌素B1a苯甲酸酯的去溶劑化溫度的LC-MS / MS優化。柱:100mm×2.1mm,3μm全多孔C18; 流動相A:水+ 2mM乙酸銨+ 0.1%甲酸; 流動相B:甲醇+ 2mM乙酸銨+ 0.1%甲酸; 梯度%B(時間):5%(0分鐘),5%(1.5分鐘),70%(6分鐘),70%(9分鐘),100%(10分鐘),100%(12分鐘),平衡; 流速:0.5 mL / min; 極性:ESI +; 幕氣:30 psi; 霧化器氣體:45 psi; 干燥氣體:55 psi; 毛細管電壓:5.5 kV; 碰撞氣體:10 psi。 |
樣品預處理
樣品預處理是LC-MS分析工作流程的重要組成部分,特別是在分析含有低濃度目標分析物的復雜樣品時。去除非目標樣品組分可以小化基質干擾并改善目標分析物的S / N比。與目標分析物共洗脫的基質化合物可能導致分析物信號的抑制或增強; 這些干擾稱為矩陣效應。基質效應通常表現為MS靈敏度或特異性的損失,并且在ESI中普遍存在,因為在發射氣相離子之前可能在液滴表面上發生電荷競爭。作為替代方案,如果感興趣的分析物是熱穩定的并且具有中等極性[1],則可以使用大氣壓化學電離(APCI)。在APCI中,通過電暈針的施加電壓,LC洗脫液在電離之前*蒸發成氣體。然后電離的流動相蒸氣與分析物分子反應產生帶電離子。基質效應在APCI中往往不那么廣泛,因為離子是通過氣相反應而不是液相反應產生的[9]。
可以使用各種樣品制備策略從潛在的干擾基質組分中提取目標分析物。適當的技術取決于樣品基質,樣品體積,目標分析物濃度和分析物理化學性質。如果樣品清潔并且已知含有高濃度的目標分析物,簡單的過濾和稀釋是降低潛在干擾濃度的快捷方便的方法。另一方面,已知含有低目標分析物濃度的復雜樣品將需要更嚴格的提取程序以改善信號強度。雖然由于需要投入的成本和時間,可能不需要更嚴格的樣品制備程序,無論選擇哪種樣品制備技術,重要的是要考慮基質效應可能是由于內源性或外源性物質的存在。盡管樣品中已存在內源性成分(蛋白質,脂質,色素等),但在樣品預處理過程中將外源化合物引入樣品中。這些化合物可以從用于離心管,孔板和移液管的塑料中浸出,并且可以包括來自制造過程的副產物和殘余物(例如,模塑劑,增塑劑,穩定劑和釋放劑)。污染物的數量和類型因制造商而異,如圖3a所示。在這個實驗中,對7家制造商的聚合物固相萃取(SPE)反相96孔板提取的污染物進行了比較。通過LC-MS分析提取物,并將得到的數據減去背景以除去溶劑和分析柱的貢獻。所得色譜圖的疊加顯示各制造商之間存在多種化學污染物。基于由44Da分開的一系列重復離子,在制造商C中清楚地識別聚乙二醇(PEG)的光譜(圖3b)。所得色譜圖的疊加顯示各制造商之間存在多種化學污染物。基于由44Da分開的一系列重復離子,在制造商C中清楚地識別聚乙二醇(PEG)的光譜(圖3b)。所得色譜圖的疊加顯示各制造商之間存在多種化學污染物。基于由44Da分開的一系列重復離子,在制造商C中清楚地識別聚乙二醇(PEG)的光譜(圖3b)。
圖3 用聚合物固相萃取反相96孔板用乙腈提取的污染物,并通過LC-MS / MS分析:(a)來自七個制造商的背景減去TIC的疊加。(b)從位于6.5-8分鐘的峰C收集的平均光譜。柱:100mm×2.1mm,2.7μm表面多孔C18; 流動相A:水+ 1mM乙酸銨+ 1%乙酸; 流動相B:甲醇; 梯度%B(時間):5%(0分鐘),100%(8分鐘),100%(9分鐘),平衡; 流速:0.5 mL / min。[10] |
流動相組成
流動相通過影響目標分析物的保留和電離,在LC-MS靈敏度中發揮關鍵作用。使用高純度溶劑和添加劑對于防止不需要的加合物形成和增加的MS背景是至關重要的。同樣,只有來自水凈化系統的超純水或適用于LC-MS的瓶裝水才能用于流動相制備。收集的MS級和HPLC級甲醇的LC-MS譜顯示HPLC級甲醇中的雜質顯著增加,特別是在小分子分析中常見的低分子量范圍內(圖4)。從該數據可以明顯看出,較低等級溶劑的使用如何有助于降低靈敏度和卷積光譜,使得定量或光譜解釋變得困難。
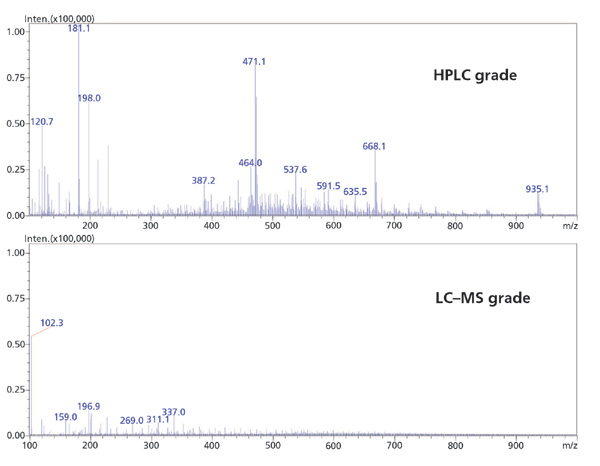 圖4 HPLC級甲醇和LC-MS級甲醇的平均光譜的比較。流動相:未指明的未改性甲醇; 流速:0.5 mL / min; 系統:采用ESI +電離的LC-MS; 掃描范圍:100-2000 m / z。 |
將揮發性緩沖液和酸結合到流動相中使得能夠控制目標分析物的電離狀態,從而可以操縱保留。分析物保留為LC-MS分析人員提供了幾個優勢。,增加的分析物保留意味著在梯度LC期間從柱中洗脫分析物需要更高的有機溶劑濃度。已經表明,具有較高有機濃度的液滴在MS源中更有效地去溶劑化,導致MS靈敏度提高[11]。其次,更高的色譜選擇性使得可以避免可能對分析物響應有害的共洗滌基質效應。通過同時輸注分析物后柱,同時通過分析柱[12]進行LC注入提取的空白基質樣品,可以色譜監測保留區域和基質抑制。基質抑制區域的特征在于分析物信號的減少。通過這種方式,可以調整分析物保留,以避免色譜圖中顯著抑制的區域。
流動相緩沖液和酸也會影響電離效率。這種說法對于ESI尤其如此,因為由于電離競爭,它易于降低檢測器響應。為了降低緩沖液誘導抑制的可能性,通常應將濃度保持在低限度。或者,含有甲酸的流動相可以使不需要的金屬加合物小化。由酸提供的質子過量驅使大部分離子形成質子化分子[M + H] +,導致響應的總體改善,因為它不再分布在多個帶電物質上[12]。
通過在酸離子改性劑的正離子模式下提供質子或通過在負離子模式下接受基本改性劑的質子,觀察到電離效率的提高。后者被證明是兩種中性雌激素,雌酮和雌三醇的負電離,當它們在含有0.2%氫氧化銨的稀釋劑中制備時,與含有0.2%乙酸的雌激素相比,它們的響應增加三倍[14]。含氨的緩沖鹽(例如,甲酸銨或乙酸銨)可以提高極性中性化合物的電離效率,所述極性中性化合物不能通過形成銨加合物而自身電離。銨鹽可用于通過提供恒定的銨供應來防止形成不需要的加合物。例如,兩種強心苷的LC-MS分析,地gao辛和洋地黃毒苷幾乎*用甲酸銨改性的流動相進行。沒有甲酸銨,這些化合物傾向于形成鈉加合物,當通過串聯MS分析時難以破碎[14]。
LC柱特性
對提高LC-MS靈敏度的渴望趨向于使用更小的顆粒(亞2μm)和減小的柱直徑(≤2.1mm)實施LC柱。與全多孔顆粒(FPP)相比,表面多孔顆粒(SPP)的引入允許提率,同時降低系統壓力。從理論上講,柱可以提高靈敏度; 但是,必須考慮LC-MS系統的柱外體積,電離效率和數據采樣率,以充分實現其優勢。
色譜柱提供窄色譜峰的能力表征為其效率(N),并由其板高(H)定義。峰的效率是其寬度和保留時間的函數。有幾個過程有助于色譜柱內外的峰展寬。進樣器,連接管和檢測器都是柱外峰展寬的來源。
在色譜柱內部,渦流擴散(A),縱向傳質(B)以及流動相和固定相傳質(C)都有助于峰的色散。總的來說,這些術語構成了van Deemter等式:

其中h是降低板高度,v是流動相線速度[2]。van Deemter方程作為比較柱性能的基礎。
提高柱效的一種方法是減小粒徑。減小總峰寬將導致峰高的整體增加。假設探測器噪聲保持不變,較高的峰值會導致S / N的改善和靈敏度的提高。此外,峰可能更加分辨,降低了基質干擾影響電離效率的可能性。
較小的顆粒柱還允許使用更快的*線速度,并且通過擴展,更快的流速 - 不會經歷效率的顯著損失。不幸的是,由于控制ESI的機制,更快的流速通常不利于靈敏度,因為必須除去所有洗脫液才能成功形成氣相離子。雖然一些制造商聲稱儀器兼容洗脫液流速高達1 mL / min,但據報道標準流量LC-ESI-MS系統的*性能發生在10-300μL/ min[16]的范圍內。為了適應小顆粒及其相關的高線速度,2.1 mm內徑色譜柱已成為標準流量LC-ESI-MS系統的首xuan尺寸,*流速為200-300μL/ min。
改變顆粒形態是提高柱效的另一種方法。表面多孔顆粒與全多孔顆粒的不同之處在于它們具有圍繞實心核的薄多孔殼。它們能夠顯著提率,因為縱向擴散(B)和渦流擴散(A)的減少是由于它們的粒徑分布窄,滲透性降低和外表面粗糙[17]。圖5使用van Deemter圖比較了全多孔3-μmC18色譜柱與相同尺寸的表面多孔2.7-μmC18色譜柱的動力學性能。與全多孔顆粒相比,表面多孔柱的效率提高了60%。
 圖5 Van Deemter圖比較3-μm全多孔C18柱和2.7-μm表面多孔C18柱之間的效率。流動相A:45%水; 流動相B:55%乙腈; 檢測:光電二極管陣列,254 nm; 注射量:1μL; 樣品:在25:75乙腈 - 水中制備的0.03mg / mL聯苯。 |
利用內徑較窄的色譜柱可zui大限度地減少分析物稀釋,這在色譜分離過程中會發生。由于柱上稀釋,分析物靈敏度與濃度依賴性檢測器[18]的柱內徑的平方成反比。因此,假設在兩種情況下都可以注入相同體積的樣品,理論上將2.1 mm內徑色譜柱切換到0.3 mm內徑色譜柱可以將靈敏度提高50倍[19]。同樣,較小的內徑柱保持相同的線速度和降低的流速,這在電離效率方面是有益的。在這些流量下,對于需要高靈敏度且樣品量有限的應用,使用非常慢的流速(每分鐘納升)已經變得流行。
將窄孔柱與質譜聯用時,有幾個含義。柱內徑的減小與效率的提高一起導致峰值體積的顯著降低。在不使儀器中的柱外體積小化的情況下,柱性能將受到損害,使得難以實現靈敏度的任何顯著增加。大多數柱外體積貢獻可歸因于LC系統,MS貢獻可忽略不計。然而,發現用于將LC柱與MS系統連接的管道是關鍵的,因為該管道位于柱后,其中不會發生補償譜帶展寬的聚焦效應[20]。根據經驗,柱外體積不應超過色譜圖中窄峰的峰值體積的三分之一[21]。例如,1.8μm,100 mm×2.1 mm色譜柱的峰容積約為8μL[16]。因此,zui大柱外體積應小于3μL,以抵消系統相關的效率損失。
較小的峰值體積也意味著需要快速采集速率來收集定量數據所需峰值的小15-20個數據點。與時間相關的譜帶展寬效應可能是由于停留時間不足和數據平滑過度造成的。在圖6中,使用三種掃描速率(300ms,50ms和5ms)分析嗎啡和氫嗎啡酮。人工展寬對于300毫秒的數據是明顯的,而5毫秒的數據顯示過度采樣的過度噪聲。不正確的停留時間設置會對數據質量和信噪比產生深遠的影響。此外,在分析大量化合物時,通過在選擇離子監測(SIM)或多反應監測(MRM)模式下收集數據可以實現更長的循環時間,以減少與時間相關的譜帶展寬效應的發生。
 圖6 采集的數據與(a)300 ms,(b)50 ms和(c)5 ms的停留時間的比較,以及它們對時間相關頻帶展寬的貢獻。系統:LC-MS / MS; 極性:ESI +。峰值:1 =嗎啡,2 =氫嗎啡酮。 |
結論
開發靈敏且穩健的LC-MS方法是一項艱巨的任務。為了解其目標分析物的物理化學性質,以及MS電離和傳輸效率的機制和局限性,分析人員可以開始做出明智的決策,以優化總體響應。提高靈敏度的簡單,zui有效的方法是優化電離源條件,以確保zui大限度地生產和將氣相離子轉移到MS系統中。可以通過使用、窄孔LC柱,較慢的LC流速,仔細選擇樣品預處理程序改善響應以及減少可能導致基質效應和基線噪音的干擾從而降低檢測限。
參考
[1] R.K. Boyd, C. Basic, and R.A. Bethem, Trace Quantitative Analysis by Mass Spectrometry, 1st Edition (John Wiley & Sons Ltd, West Sussex, England, 2008), pp. 242, 249.
[2] L.R. Snyder, J.J. Kirkland, and J.W. Dolan, Introduction to Modern Liquid Chromatography, 3rd Edition (John Wiley & Sons, Hoboken, New Jersey, 2010), pp. 39–45, 157.
[3] J.S. Page, R.T. Kelly, K. Tang, and R.D. Smith, J. Am. Soc. Mass Spectrom. 18, 1582–1590 (2007).
[4] G.I. Taylor, Proc. R. Soc. Lond. A. 280, 383 (1964).
[5] M. Wilm, Mol Cell Proteomics 10, 1–8 (2011).
[6] A. Kiontke, A. Oliveira-Birkmeier, A. Opitz, and C. Birkemeyer, PLoS One 11, 1–16 (2016).
[7]T. Taylor, LCGC Blog (7 November, 2017).
[8]O. Szerkus, A.Y. Mpanga, M.J. Markuszewski, R. Kaliszan, and D. Siluk, Spectroscopy 14, 8–16 (2016).
[9] R. Dams, M.A. Huestis, W.E. Lambert, and C.M. Murphy, J. Am. Soc. Mass Spectrom. 14, 190–1294 (2003).
[10] Y. Hua and D. Jenke, J. of Chromatogr. Sci. 50, 213-227 (2012).
[11] S.R. Needham, P.R. Brown, K. Duff, and D. Bell, J. Chromatogr. A 869, 159-170 (2000).
[12]R. Bonfiglio, R.C. King, T.V. Olah, and K. Merkle, Rapid Commun. Mass Spectrom. 13, 1175–1185 (1999).
[13]F. Klink, MS Solutions #3.
[14]S. Lupo and T. Kahler, LCGC North America 35, 424–433 (2017).
[15]J. Boertz, X. Lu, H. Brandes, S. Squillario, D. Bell, and W. Way, Poster Session presented at the Annual Meeting of the German Society for Mass Spectrometry (DGMS), Wuppertal, Germany (2015).
[16]S. Buckenmaier, C.A. Miller, T. van de Goor, and M.M. Dittman, J. Chromatogr. A 1377, 64–74 (2015).
[17]G. Guiochon and F. Gritti, J. Chromatogr. A 1218, 1915–1938 (2011).
[18]J.P.C. Vissers, H.A. Classens, and C.A. Cramers, J. Chromatogr. A 779,1–28 (1997).
[19]J. Abian, A.J. Oosterkamp and E. Gelpi, J. Mass. Spectrom. 34, 244–254 (1999).
[20]D. Spaggiari, S. Fekete, P.J. Eugster, J. Veuthey, L. Geiser, S. Rudaz, and D. Guillarme, J. Chromatogr. A 1310, 45–55 (2013).
[21]A.J. Alexander, T.J. Waeghe, K.W. Himes, F.P. Tomasella, and T.F. Hooker, J. Chromatogr. A 1218, 5456–5469 (2011).
 掃碼加微信
掃碼加微信